Разделы сайта
Выбор редакции:
- Правила вычисления производных
- Иван III – Государь всея Руси
- Первые металлургические мануфактуры тульского края Где появились первые металлургические заводы
- Формирование ууд на уроках в начальной школе презентация к уроку на тему
- Презентация "герой сталинградской битвы василий григорьевич зайцев"
- Маргинал или изгой общества Кто это такой
- Студенческие строительные отряды (ссо - вссо) Движение вссо как называли в ссср
- Целебные свойства марганцовки — полезные советы
- Подготовка к егэ по обществознанию
- Гитлер в «Mein Kampf»: «Русские – великий народ» - aquilaaquilonis
Реклама
| Уф анализ. ОФС.2.1.0003.15 Спектрофотометрия в УФ и видимой областях. Характеристика уф-спектров, используемая при идентификации некоторых лекарственных веществ в фармакопейном анализе |
|
ГОУ ВПО Иркутский государственный медицинский университет РОСЗДРАВА РФТыжигирова В.В., Филиппова С.Ю. ПРИМЕНЕНИЕ ИК– и УФ– СПЕКТРОСКОПИЧЕСКИХМЕТОДОВ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕУчебное пособие по фармацевтической химии для студентов фармацевтического факультета старший преподаватель кафедры фармацевтической и токсикологической химии ИГМУ, к.ф.н. Тыжигирова В.В., ассистент кафедры фармацевтической и токсикологической химии ИГМУ, к.ф.н. Филиппова С.Ю. Рецензенты: Зав. кафедрой фармакогнозии с курсом ботаники ИГМУ, доктор фармацевтических наук, профессор Федосеева Г.М., Профессор кафедры химической технологии ИГТУ, доктор химических наук Шаглаева Н.С. Печатается по решению ЦКМС ИГМУ (протокол № от) Введение Настоящее пособие подготовлено для студентов фармацевтического факультета с целью освоения анализа лекарственных средств ИК– и УФ– спектроскопическими методами. Современные нормативные документы по анализу лекарственных средств предполагают широкое использование этих методов. ИК– спектроскопия является основным методом в испытаниях лекарственных веществ на подлинность. УФ–спектрофотометрия применяется для оценки качества как лекарственных веществ, так и изготовленных из них препаратов по показателям подлинность, доброкачественность и количественное содержание. Кроме того, метод широко используется при оценке качества твердых дозированных лекарственных форм по показателям «Растворение» и «Однородность дозирования». В пособии кратко излагаются основы методов, их возможности и ограничения. Приводится материал по применению методов в анализе лекарственных средств с различными целями. Излагаемый материал сопровождается конкретными примерами по использованию методов в фармацевтическом анализе. В конце пособия для самоконтроля освоения материала приводятся контрольные вопросы, тестовые задания, ситуационные задачи с пояснениями. Предлагается перечень задач для самостоятельной работы студентов и эталон решения одной из них. Пособие составлено в соответствии с типовой программой по фармацевтической химии (2001г) и предназначено для самостоятельной подготовки студентов к циклу занятий по анализу лекарственных средств спектрофотометрическими методами. 1. Характеристика спектроскопических методов анализа К спектроскопическим методам анализа относят физические методы, основанные на взаимодействии электромагнитного излучения с веществом. Электромагнитное излучение имеет двойственную природу: волновую и корпускулярную, поэтому оно может быть охарактеризовано волновыми и энергетическими параметрами. К волновым параметрам относятся: длина волны - расстояние, проходимое волной за время одного полного колебания. Длину волны обычно выражают в нанометрах нм 110 м или в микрометрах мкм 110 м; 9 частота - число раз в секунду, когда электромагнитное поле достигает своего максимального значения. Для измерения частоты используют герц; волновое число - число длин волн, укладывающихся в единицу длины: 1. Волновое число измеряют в обратных сантиметрах см 1. Корпускулярная природа света характеризуется энергией квантов электромагнитного излучения. В системе СИ энергию измеряют в джоулях. описывается уравнением Планка: - изменение энергии элементарной системы в результате поглощения фотона с энергией h ; c - скорость света (3 1010 см с-1). При поглощении квантов света происходит увеличение внутренней энергии частицы, которая складывается из энергии движения электронов ЕE, колебательной энергии атомов молекулы EV и энергии вращения Величина этих энергий убывает в порядке: ЕE EV ЕR, а их числовые значения относятся как: 103: 102: 1. Как видно из представленного соотношения, в зависимости от величины энергии электромагнитного излучения в молекуле возможны различные энергетические переходы. Если в соответствии с уравнением (1) учесть, что длина волны и энергия излучения связаны обратной пропорциональной зависимостью, то в электромагнитном спектре можно выделить определенные участки (таблица 1). соответствующие им процессы энергетических переходов Взаимодействие электромагнитного излучения с веществом в оптической (ультрафиолетовой, видимой, инфракрасной) области лежит в основе спектрофотометрического метода, который широко используется в фармацевтическом анализе. Поглощение электромагнитного излучения в УФ-, видимой и ИКобластях спектра количественно описывается законом Бугера- ЛамбертаБера, который выражает зависимость интенсивности монохроматического светового потока, прошедшего через слой поглощающего вещества (I), от интенсивности светового потока, падающего на него (I концентрации поглощающего вещества (с), толщины поглощающего слоя (L) и от молярного показателя поглощения (), характеризующего поглощающее вещество: Для измерения степени поглощения электромагнитного излучения сконструированы приборы, позволяющие определять не интенсивность электромагнитного потока, а его ослабление, обусловленное поглощением анализируемого вещества. А для характеристики степени поглощения электромагнитного излучения введены такие фотометрические величины как пропускание и оптическая плотность. Пропускание (Т) – это отношение интенсивности светового потока, прошедшего через слой поглощающего вещества, к интенсивности падающего светового потока: Исходя из формул (2) и (3) можно записать: Пропускание изменяется в пределах от 0 до 1 и обычно выражается в процентах (%) от 0 до 100. Неудобство исчислений привело к тому, что ввели другую фотометрическую величину - оптическую плотность (D) как десятичный логарифм величины, обратной пропусканию: практически измеряется в пределах от 0 до 2. Формула (5) наглядно показывает, что поглощение электромагнитного излучения веществом не зависит от интенсивности светового потока, но зависит от природы вещества и прямо пропорционально концентрации вещества и толщине поглощающего слоя. Из формулы (5) видно, что на основании измеренной оптической плотности можно вычислить показатель поглощения по формуле: Концентрация (С) может быть выражена в молях на 1 литр или в граммах на 100 мл раствора и в зависимости от этого по формуле (6) вычисляют молярный или удельный показатель поглощения: – молярный показатель поглощения представляет собой оптическую плотность одномолярного раствора вещества при толщине поглощающего слоя 10 мм. оптическую плотность 1% раствора при толщине поглощающего слоя см. Коэффициент поглощения в УФ–областиможет достигать больших значений (до 105 л см-1 моль-1). В ИК–области величина имеет незначительные значения и обычно не определяется. 3. Характеристика спектрофотометров Независимо от области спектра приборы для измерения пропускания или поглощения состоят из 5 основных узлов: 1 – источник излучения энергии; 2 – диспергирующее устройство, позволяющее выделить ограниченную область длин волн; 3 – кюветы для пробы и растворителя; 4 – детектор, превращающий энергию излучения в измеряемый сигнал; 5 – индикатор сигнала со шкалой. Источник излучения в УФ–области – водородная или дейтериевая лампа. В водородной лампе происходит свечение водорода при разряде, причем возникает практически сплошное излучение в области 200 – нм. ИК–излучение получают от инертного твердого тела, нагретого электрическим током до очень высокой температуры. Так, например, стержень из карбида кремния, называемый глобаром, при нагревании до 1500 0 С между двумя электродами излучает энергию в области 1 – 40 мкм. Монохроматор – это диспергирующее устройство, разлагающее излучение на составляющие его волны разной длины. Наиболее универсальными монохроматорами в УФ–области являются призмы, изготовленные из кварца или стекла. Для ИК–спектроскопии используют призмы из галогенидов щелочных или щелочноземельных металлов. С диспергирующим элементом связана система линз, зеркал и щелей, которая направляет излучение с требуемой длиной волны от монохроматора к детектору прибора. Детекторы – в УФ–области обычно применяют фотоэлементы, позволяющие световую энергию преобразовать в электрическую. ИК–излучение обнаруживают по повышению температуры зачерненного материала, помещенного на пути потока. Измерительная шкала спектрофотометра проградуирована в процентах пропускания Т (I 1 0 0) и в величинах оптической плотности D (lg I), а шкала длин волн или волновых чисел - в нанометрах или обратных сантиметрах соответственно. Спектрофотометры представляют собой комбинацию из основных узлов, рассмотренных выше, и различаются по сложности и рабочим характеристикам. Спектрофотометры бывают одно- и двухлучевые. Наиболее часто применяются двухлучевые приборы, в которых световой поток разделяется на два – основной и поток сравнения. При таком способе измерения большинство случайных помех от источника и детектора компенсируются, что обеспечивает меньшую погрешность определения. Принципиальное отличие УФ– и ИК– спектрометров заключается в различном расположении кювет: между диспергирующим устройством и фотоприемником в УФ–спектрофотометрах или между источником излучения и диспергирующим устройством в ИК–спектрометрах. Это объясняется тем, что в УФ области поглощение может достигать больших величин, что позволяет достаточно точно измерить поглощение монохроматичного светового потока. В ИК–области поглощение принимает незначительные значения, что затрудняет его непосредственное измерение. Поэтому для регистрации ИК–спектров используют так называемую обращенную конструкцию приборов, в которых фиксируется весь спектр излучения, прошедший через вещество. Тогда ИК–спектр будет иметь высокие значения пропускания во всей области кроме участка, при котором произошло поглощение. Поэтому шкала регистрирующего устройства в ИК–спектрометрах проградуирована на пропускание. УФ– спектрофотометры откалиброваны как на пропускание, так и на оптическую плотность. 4. Характеристика спектров поглощения Важнейшей характеристикой электромагнитного излучения является его спектр. Спектры поглощения в УФ– и ИК– областях имеют различную природу и характеризуются как электронный и колебательный спектры соответственно. Если органическая молекула взаимодействует с излучением в УФ– области спектра, то при определенной частоте произойдет поглощение кванта энергии, сопровождающееся переходом валентных электронов с основного на возбужденный уровень. Поэтому физическую природу полос поглощения в УФ–области связывают с электронными переходами: при поглощении молекулой электромагнитного излучения в УФ–области происходит переход между электронными уровнями молекулы. Различные электронные переходы требуют неодинаковой энергии, поэтому полосы поглощения располагаются при разных длинах волн. Типы электронных переходов из основного состояния со связывающих и орбиталей и с несвязывающих n орбиталей в возбужденное состояние на разрыхляющие и орбитали представлены в таблице 2. Таблица 2. Типы электронных переходов Наличие в структуре одинарных связей (–С–С–) и изолированных хромофорных групп (-СН=N; -N=N-; -N=O и др.) обусловливает поглощение в дальней УФ–области (100–200 нм.). Однако поглощение в дальней УФ–области (до 200 нм) аналитического значения не имеет, поскольку современные спектрофотометры работают в области спектра, начиная с 180–200 нм. Для целей спектрофотометрического анализа используются электронные переходы сопряженных связей. Сопряжение подуровней, переходы электронов на которых требуют значительно длинноволновую область спектра и обладает высокой интенсивностью. На положение и интенсивность полос поглощения большое влияние оказывают электронодонорные (-NH2, -OH, -SH) и электроноакцепторные (-N=O, -NO2, и др.) заместители, играющие роль ауксохромов. Они вступают в p, и, сопряжение с -электронной системой хромофора и вызывают смещение в ней электронной плотности, снижая тем самым энергию соответствующих переходов. Полосы поглощения сдвигаются в длинноволновую область спектра (так называемый батохромный эффект). Кроме того, делокализация электронов повышает интенсивность полос поглощения (так называемый гиперхромный эффект заместителя). Таким образом, в УФ–области поглощают молекулы, имеющие в своей структуре хромофорные группы, сопряженные между собой. Чем длиннее система сопряжения, тем в более длинноволновой области спектра поглощает вещество. Спектр поглощения в УФ–области выражают в виде графической зависимости оптической плотности (D) или молярного коэффициента поглощения () от длины волны () падающего света. Вместо D или нередко используют их логарифмы. Длина волны может быть выражена в различных единицах – нм или мкм. Построение спектра в различных координатах отразится на его характере, поэтому требует регламентации в нормативных документах. УФ–спектр характеризуется как электронный, но при возбуждении электронов будет изменяться энергия колебательного движения атомов и энергия вращательного движения молекулы, поэтому в спектре появляется ряд линий, которые, сливаясь, образуют широкие полосы поглощения (рис. 1). Полосы поглощения в УФ–спектре, как правило, характеризуются расположением max и интенсивностью, выраженной через удельный показатель поглощения (Е1см). Полосы поглощения в УФ–области имеют тенденцию к уширению, поэтому УФ–спектры малоселективны. Однако они дают надежную информацию о наличии в структуре определяемого вещества системы сопряженных связей. хромофорную систему, включающую двойную связь –С=С–, сопряженную с карбонильной группой –С=О, а енольный гидроксил, расположенный на конце цепи сопряжения, играет роль ауксохрома. характерный максимум поглощения max = 243 нм и значение удельного показателя поглощения Е1см = 543, которые используются для определения ее подлинности. Рис. 1. УФ–спектр 0,001 % раствора кислоты аскорбиновой Полосы, связанные с возбуждением колебательных уровней энергии, расположены в области спектра примерно от 300 до 4000-5000 см-1, что соответствует энергии квантов ИК–излучения (3 – 60 кДж/моль). Энергия ИК–излучения недостаточна для осуществления электронных переходов; под действием ИК–излучения возможны только колебательные и вращательные переходы. Вследствие этого физическую природу полос поглощения в ИК– области связывают с колебаниями атомов в молекуле: при поглощении молекулой электромагнитного излучения в ИК–области происходит переход между колебательными уровнями энергии одного электронного состояния. При этом изменяются также и вращательные уровни энергии, поэтому ИК–спектры являются колебательно – вращательными. колебательные движения. Нормальные колебания принято подразделять на валентные, характеризующиеся движением атомов по осям связей, и деформационные, при которых изменяются валентные углы, в то время как длины связей практически не меняются. При нормальном колебании все ядра молекулы колеблются с одинаковой частотой и фазой, хотя амплитуды их колебаний могут существенно различаться. Поэтому в нормальном колебательном состоянии в молекуле центры тяжести положительных и отрицательных зарядов совпадают и, следовательно, молекула будет в целом неполярной, хотя каждая химическая связь может быть поляризована. При поглощении ИК–излучения амплитуда колебаний атомов в колебательные квантовые уровни. При этом колебательный процесс сопровождается общим изменением диполя молекулы. Таким образом, в ИК–области поглощают молекулы, у которых при возбуждении колебательных движений атомов изменяется электрический момент диполя. Частота колебаний зависит от массы атомов в молекуле и действующих между ними сил. А число колебательных состояний молекулы в значительной степени определяется числом атомов и, следовательно, числом образованных ими связей. Спектр поглощения в ИК–области выражают в виде графической зависимости пропускания (Т) от частоты (), выраженной в обратных сантиметрах. ИК–спектр характеризуется серией близкорасположенных полос поглощения, которые описывают по положению в спектре и относительным интенсивностям: сильное, среднее, слабое (рис. 2). В спектрах выделяют характеристические полосы и область «отпечатков пальцев». В область 1300 – 400 см-1 попадают полосы поглощения, отвечающие колебаниям одинарных связей С–С, C–N, C–O. В результате того, что атомы C, N и О близки по массе и соединены связями, примерно одинаковыми по энергии, отнесение полос к отдельным группам и связям невозможно. Однако весь набор полос в этой области спектра является характеристикой ядерного скелета молекулы в целом. Эта область называется областью «отпечатков пальцев». Если в атомной группировке связи и массы атомов сильно отличаются от параметров остальной части молекулы, то колебания наблюдаются в узком интервале частот и проявляются в спектрах всех соединений, содержащих эту группировку. Такие колебания называются характеристическими (групповыми), и они проявляются в области 4000 – 1300 см-1. Так, характеристическими будут колебания групп, содержащих легкий атом водорода (С–Н, О–Н, N–Н и др.), и колебания групп с кратными связями (С = С, С = С, С = N, С = О, N = N и т.д.). Как видно, характеристические колебания соответствуют атомам, входящим в состав функциональных групп. Положение характеристических полос в спектре практически не зависит от углеродного скелета, с которым связана группа, и дает ценную информацию относительно общего строения молекулы. Для проведения структурного анализа веществ по их колебательным спектрам существуют специальные корреляционные таблицы. Таблица 3. Характеристические максимумы поглощения некоторых Связи атомов имеющие характеристическую частоту ИК–спектры даже относительно простых соединений состоят из огромного числа острых максимумов и минимумов. Однако именно это множество пиков и обусловливает отчасти специфичность спектра. Так, в ИК–спектре кислоты аскорбиновой (рис. 2) наблюдается интенсивная соответствующая двойной С=С связи; полоса поглощения в области ненасыщенном кольце – лактона. Кроме того, наблюдается серия характеристических полос поглощения в области 3500 – 3200 см 1, обусловленных валентными колебаниями спиртовых и ен–диольных гидроксильных ОН групп. В области «отпечатков пальцев» выражены полосы поглощения, характеризующие одинарные С–С и С–О связи. Интерпретация ИК–спектров достаточно сложна, поэтому параллельно получают ИК–спектр стандартного образца кислоты аскорбиновой. Спектр анализируемого вещества должен иметь совпадение полос поглощения по положению и относительным интенсивностям со стандартным спектром. 5. Подготовка пробы для фотометрических определений приготовлению раствора соответствующей концентрации. Поскольку спектрофотометрический метод является высокочувствительным, фотометрируют растворы с очень малой концентрацией 10-6 – 10-8 г/мл. Чтобы уменьшить ошибку на стадии взятия микронавески, ее увеличивают до макро, а затем используют прием разведения. обоснованного выбора растворителя для спектрофотометрических определений. Прежде всего, он должен быть прозрачным в измеряемой области спектра, для чего учитывают его предел пропускания (таблица 4). используемых в фотометрии растворителей обусловливать ионизацию вещества, что приводит к перераспределению электронной плотности в цепи сопряжения и, следовательно, изменению рисунка спектра. При ионизации по кислотному типу в молекуле появляется дополнительная неподеленная пара электронов, что приводит к интенсивности. Ионизация по основному типу (протонизация) часто может привести к обратному эффекту, так как неподеленная электронная пара связывается с протоном, что приводит к снижению влияния заместителя. Наглядным примером влияния характера растворителя на рисунок спектра может служить положение полосы поглощения в спектре кислоты фолиевой (max = 320 нм в растворе кислоты, max = 365 нм в растворе щелочи). Кислота фолиевая имеет в своей структуре функциональные группы как кислотного, так и основного характера, которые позволяют использовать в качестве растворителей для спектрофотометрических определений растворы кислот и щелочей: Наибольший батохромный сдвиг полосы поглощения в спектре фолиевой кислоты наблюдается в растворе натрия гидроксида, поскольку растворение вещества в растворе щелочи сопровождается ионизацией по кислотному типу. Причем основной вклад в сопряжение вносит анионный атом кислорода при С 4 гетероциклической системы – птерина. Приготовление анализируемой пробы в ИК–спектроскопии связано с дополнительными трудностями, обусловленными тем обстоятельством, что большинство растворителей не прозрачны в ИК–области, и поэтому выбор растворителя требует особой тщательности. При этом следует учитывать не только его прозрачность в ИК–области спектра, но и возможность влияния на поглощающую систему. Так, например, вода вообще исключается и не только из-за сильного поглощения, но и вследствие воздействия на материалы, из которых изготовлены кюветы и оптическая часть приборов. Из всех растворителей наиболее пригодны четыреххлористый углерод и сероуглерод, применение которых также имеет ограничения: первый используют в области до 7,6 мкм, второй – в интервале 7,6 – 15 мкм. Для уменьшения поглощения излучения растворителем приходится использовать узкие кюветы толщиной 0,1 – мм. В то же время, приходится увеличивать концентрацию растворов до – 4,5 %, чтобы величина пропускания при измерениях в ИК–области принимала оптимальные значения. Наиболее часто анализируемую пробу для ИК–спектрометрии готовят путем получения таблеток, когда анализируемый образец измельчают, смешивают со спектроскопически чистым калия бромидом и прессуют; или путем получения пасты, когда испытуемый образец растирают с вазелиновым или другим прозрачным в ИК–области минеральным маслом, а затем полученную пасту сдавливают между двумя пластинками из натрия хлорида. 6. Сравнительная характеристика абсорбционных методов Важнейшими характеристиками любого метода, в том числе и фотометрического. являются его чувствительность и точность. Количественно чувствительность спектрофотометрических определений можно охарактеризовать коэффициентом чувствительности S, который определяет, насколько изменяется оптическая плотность раствора при очень малом изменении концентрации определяемого вещества. Математически он выражается первой производной от оптической плотности по концентрации: Таким образом, чувствительность пропорциональна молярному показателю поглощения и, чем он больше, тем меньшее количество вещества при прочих равных условиях можно определить. Значение молярного коэффициента поглощения в УФ– и видимой областях спектра в десятки раз больше, чем в ИК– диапазоне. Толщина поглощающего слоя, используемая при измерениях, составляет для УФ– области спектра 1 см, для видимой области – 0,5–5,0 см; для ИК–области см. Поэтому чувствительность фотометрического определения в УФ– и видимом диапазоне намного выше, чем в ИК–диапазоне, и для УФ– области составляет 10-4–10-6 от молярной массы определяемого вещества. Погрешность при спектрофотометрическом определении концентрации (С) можно охарактеризовать, выражая ее как функцию оптической плотности и толщины поглощающего слоя: Таким образом, погрешность определения концентрации С будет тем меньше, чем больше и l, что характерно для УФ– и видимой области спектра. Исходя из вышеизложенного следует, что для целей количественного анализа спектрофотометрия в УФ– и видимой областях спектра имеет преимущества перед ИК–спектроскопией. В то же время, как было показано при характеристике спектров, ИК–спектроскопия является более селективным и информативным методом и поэтому широко используется для целей качественного анализа. 7. Применение спектрофотометрии в фармацевтическом анализе ИК–спектроскопия в фармацевтическом анализе наиболее широко применяется с целью определения подлинности. Это объясняется большой специфичностью колебательного спектра. Идентификация лекарственного вещества может быть проведена путем сопоставления ИК–спектра исследуемого вещества с аналогичным спектром его стандартного образца или с рисунком стандартного спектра, приведенного в фармакопейной статье. На практике при интерпретации спектров определяют положение полос поглощения и их интенсивность (сильная, средняя, слабая). Сопоставление ИК–спектров рекомендуется начинать с анализа характеристических полос, которые обычно хорошо проявляются на спектрах, и лишь при их совпадении сопоставляют низкочастотную область. Совпадение спектральной кривой исследуемого вещества с рисунком стандартного спектра свидетельствует об идентичности двух веществ. Отсутствие в спектре исследуемого вещества полос, наблюдаемых в спектре стандартного образца, однозначно указывает на то, что эти вещества различны. Присутствие в спектре исследуемого вещества большего числа полос, по сравнению со спектром стандарта, может быть объяснено как загрязнением исследуемого вещества, так и различием обоих веществ. Таким образом, ИК-спектр испытуемого образца должен иметь полное совпадение полос поглощения с полосами поглощения стандартного спектра по положению и относительной интенсивности. фармацевтическом анализе можно рассмотреть ИК–спектры близких по структуре стероидных соединений: кортизона ацетата, гидрокортизона ацетата и преднизолона (рис. 6 – 8). Наиболее характерной для всех трех веществ является область 1600 – см 1, на которую приходятся валентные колебания группировки С = С при С 4 средней степени интенсивности (1606 – 1626 см 1), валентные колебания групп С = О при С 3 и С 11 (1656 – 1684 см 1), группы С = О при С 20 (1706 – 1733 см 1). На всех спектрах выражены максимумы в области от 3200 до 3500 см 1, которые соответствуют колебаниям свободной гидроксильной группы. Кортизона ацетат и гидрокортизона ацетат являются сложными эфирами, что проявляется на их ИК–спектрах в виде характерных полос в области 1219 – 1279 см 1. Данные полосы поглощения отсутствуют в спектре преднизолона. Зато для ИК–спектра преднизолона, как 3-кето-1, прегнадиена присутствует полоса сильной степени интенсивности валентных колебаний С = С связи при С 1 (1595 см 1). идентификацию стероидов близкой структуры по положению основных полос в спектре и их относительным интенсивностям. В фармацевтическом анализе для целей количественного определения трудностей, не позволяющих добиться сопоставимой точности. К ним относятся необходимость измерения в очень узкой кювете, длину которой трудно воспроизвести; высокая вероятность перекрывания полос поглощения; небольшая ширина полосы поглощения в максимуме, что приводит к отклонениям от основного закона светопоглощения. туре стероидных соединений. Так, на рис. 6 – 8 приведены ИК– спектры кортизона ацетата, гидрокортизона ацетата и преднизолона. 7.2. Применение УФ – спектрофотометрии в анализе УФ–спектроскопия в фармацевтическом анализе применяется с различными целями. структурой, целесообразно применение УФ–спектрофотометрии в целях используются такие спектральные характеристики, как положение и интенсивность полос поглощения. Определение подлинности УФ–спектрофотометрическим методом может осуществляться различными способами. Один из них основан на построении спектральной кривой и определении на ней характерных, так называемых аналитических длин волн, при которых наблюдается максимальное (мах), минимальное (min) регламентируются не строго определенные значения мах и min, а их допустимые интервалы. Это обстоятельство объясняется допустимой ошибкой калибровки шкалы длин волн на различных приборах. Поскольку УФ–спектр имеет одну, две, реже три широкие полосы использовать. Однако в ФС строго регламентируются условия определения (растворитель, концентрация рабочего раствора), а спектральная кривая должна строиться в координатах или D, регламентированных в ФС. поглощения при заданной аналитической длине волны, выраженной через удельный показатель поглощения Е 1%. Сущность определения сводится к измерению оптической плотности анализируемого образца при мах и сопоставляется с величиной удельного показателя поглощения, который, в свою очередь, определяется по стандартному образцу для анализируемого лекарственного вещества и приводится в ФС в виде допустимого интервала. спектрофотометрии в целях определения подлинности веществ, имеющих в структуре систему сопряженных связей, является обязательным, но ввиду малой селективности рассматривается как дополнительный метод в блоке испытаний. Так, вещества с однотипной системой сопряженных связей характеризуются поглощением в одинаковой области спектра. Наглядный тому пример – спектральные характеристики стероидных соединений: преднизолона, кортизона ацетата и гидрокортизона ацетата (рис. 3 – 5). Как видно из рис. 3–5, в структуре этих веществ имеется однотипная хромофорная система, возникающая вследствие сопряжения карбонильной группы при С 3 и двойной связи при С 4. Поэтому данные вещества поглощают в одинаковой области спектра при длинах волн 238 – 242 нм. В целом, поглощение, обусловленное хромофорной системой 4–ен–3–он связей, является аналитическим для стероидных соединений и может рассматриваться как общегрупповое испытание для данного класса веществ. Эргокальциферол и ретинола ацетат, относящиеся к одной группе витаминов алициклического ряда, отличаются числом сопряженных двойных связей и поэтому поглощают в разных областях спектра. Эргокальциферол имеет в своей структуре систему из трех сопряженных двойных связей. Сопряжение двойных –С=С- связей обусловливает поглощение эргокальциферола при 265 нм с удельным показателем 480 – 485. В основе ретинола ацетата также лежит алициклическая структура: Однако, в отличие от эргокальциферола, ретинол имеет пентаеновую цепь сопряжения. Увеличение числа сопряженных связей приводит к снижению энергии электронных переходов и, как следствие, сдвигу полосы поглощения в длинноволновую область с увеличением ее интенсивности. Ретинола ацетат имеет выраженный максимум поглощения в более длинноволновой, по сравнению с эргокальциферолом, области спектра при 326 нм, а удельный показатель поглощения принимает значение 1550. Фотометрические характеристики других лекарственных веществ из класса витаминов, алкалоидов, стероидных гормонов и антибиотиков, используемые для аналитических целей, приведены в таблицах 5 – 9. специфических примесей в лекарственных веществах. поглощения (), тем меньшее количество вещества можно определить. Применение метода для определения примеси обосновано только в том коэффициента поглощения. Такая примесь называется светопоглощающей. Определение примесей спектрофотометрическим методом сводится к двум случаям. Если примесь поглощает в области спектра, отличной от области поглощения лекарственного вещества, то о наличии примеси судят по появлению дополнительной полосы поглощения в спектре. Примером гидротартрате: Сопряжение ароматического кольца с двумя –ОН группами, расположенными в орто–положении по отношению друг к другу, обусловливает поглощение адреналина в УФ–области при длине волны 279 нм. Адренолон, являясь продуктом окисления адреналина, имеет хиноидную структуру, которая обусловливает поглощение в более длинноволновой области спектра при 310 нм. Примесь может поглощать в области спектра, характерной для лекарственного вещества. В таком случае о наличии примеси судят по увеличению оптической плотности при аналитической длине волны. Использование этого приема возможно при условии соблюдения закона аддитивности, согласно которому оптическая плотность суммы веществ равна сумме оптических плотностей отдельных веществ при условии независимого поглощения этих веществ: D A D B D A B Поскольку абсолютные значения оптической плотности плохо воспроизводятся, определяют относительное значение – отношение оптических плотностей при различных аналитических длинах волн:. Так, например, данный прием используется при определении поглощающих примесей в цианокобаламине. Определяют оптическую плотность раствора лекарственного вещества при 278 нм, 361 нм и 548 нм. Затем вычисляют отношения оптических плотностей, которые должны входить в интервалы, приведенные в ФС: Таблица 5. Фотометрические характеристики некоторых лекарственных Таблица.6. Фотометрические характеристики стероидных гормонов ацетат Таблица 7. Фотометрические характеристики некоторых фениламинов Таблица 8. Фотометрические характеристики некоторых лекарственных Дротаверина гидрохлорид 0,1 моль/л Таблица 9. Фотометрические характеристики некоторых лекарственных Бензилпенициллина Вода Производные нитрофенилалкиламинов используется достаточно широко. Применение метода основано на существовании прямо-пропорциональной зависимости величины поглощения от концентрации вещества в анализируемом растворе: спектрофотометрическим методом: графический по калибровочному графику; сравнительный относительно стандартного образца; расчетный по удельному показателю поглощения (Е1%1см). Первый способ наиболее рационален при проведении серийных анализов. Сущность его сводится к следующему: готовится серия разведений стандартного образца в интервале концентраций, при которых наблюдается подчинение закону Бугера–Ламберта–Бера. Измеряется оптическая плотность растворов стандартного образца и строится калибровочный график. Затем готовится раствор анализируемого образца в концентрации, примерно соответствующей середине калибровочного графика, и измеряется его оптическая плотность (DX) на том же приборе определяется значение СХ, г/мл (рис.6). Рис. 6. Калибровочный график анализируемого образца и способ ее разведения: Второй способ количественного определения сводится к следующему: параллельно готовятся растворы анализируемого и стандартного образцов примерно одинаковой концентрации (СХ и СС.О) и измеряется их оптическая плотность (DX и DС.О.) при равных условиях (max, l.) В соответствии с основным законом светопоглощения можно записать: Учитывая, что и l одинаковы, объединяя оба уравнения, получают: DCO CCO DCOДалее в расчетной формуле учитывают величину макронавесок стандартного и анализируемого образцов и способ их разведения:Данный способ является более точным, поэтому широко применяется при выполнении единичных анализов. Если в лаборатории отсутствуют стандартные образцы, расчеты в количественном анализе можно произвести по известному значению Е1%1см по формуле: Однако этот способ анализа наименее предпочтителен, поскольку в данном случае возрастает роль ошибок, обусловленных индивидуальными характеристиками приборов. Для обеспечения требуемой точности анализа необходимо научно обосновать условия количественного определения. Выбор аналитической длины волны. Для этой цели строят спектральную кривую зависимости оптической плотности от длины волны по раствору стандартного образца. На спектральной кривой определяют аналитические длины волн, соответствующие длинам волн максимального поглощения. Из всех имеющихся в спектре полос поглощения для целей количественного анализа выбирают такую, которая характеризуется светопоглощения обеспечивает наиболее высокую чувствительность определения. С другой стороны, более предпочтительными являются пологие максимумы, т. к. при этом меньше сказывается погрешность в установлении длины волны. подчинение закону Бугера–Ламберта–Бера. Для этого готовят серию разведений стандартного образца и при выбранной аналитической длине волны измеряют значения их оптических плотностей. По полученным данным строят калибровочный график – графическую зависимость оптической плотности от концентрации. Поглощение электромагнитного излучения веществом подчиняется основному закону светопоглощения при том интервале концентраций, при котором график представляет собой прямую линию, выходящую из начала координат (рис. 7). Рис. 7. Калибровочный график Cn - Cm – область концентраций, в которой наблюдается подчинение закону Бугера–Ламберта–Бера Погрешность определения сильно возрастает при отсутствии прямопропорциональной зависимости величины поглощения от концентраций. Это наглядно можно продемонстрировать с помощью рисунка 8. Рис. 8. Калибровочный график: 1 – при соблюдении закон Бугера–Ламберта–Бера, 2 – при несоблюдении закон Бугера–Ламберта–Бера На рисунке 8 видно, что при одной и той же погрешности определения оптической плотности D1 =D2, погрешность определения концентраций С2 в случае невыполнения закона Бугера–Ламберта–Бера превышает погрешность С1, когда закон выполняется. Выбор рабочего диапазона оптической плотности (D). Установлено, что относительная погрешность измерения оптической плотности принимает минимальные значения при D = 0,434. Поэтому стараются работать в области значений оптических плотностей от 0,3 до 0,8, в которой прибор откалиброван с наибольшей точностью. Поскольку оптическая плотность прямо-пропорционально зависит от концентрации вещества в анализируемой пробе и толщины поглощающего слоя, именно этими параметрами стоит варьировать для выбора оптимальных значений оптической плотности. В то же время концентрацию выбирают таким образом, чтобы ее значение укладывалось в интервале, при котором наблюдается подчинение закону Бугера–Ламберта–Бера. Выбор стандартного образца (СО). Спектрофотометрия является относительным методом и, следовательно, требует использования стандартных образцов, в качестве которых могут использоваться государственные стандартные образцы (ГСО) или рабочие стандартные образцы (РСО). При выполнении анализа субстанций используют ГСО, а при анализе лекарственных препаратов допускается применение РСО. Подготовка анализируемого образца. Измерение поглощения в УФ– области осуществляется в растворах. Ввиду высокой чувствительности спектрофотометрического метода рабочая концентрация раствора СX имеет низкие значения. Поэтому в методике спектрофотометрического определения должна быть регламентирована научнообоснованная величина макронавески и мерная посуда, используемая для ее разведения. Выбор раствора сравнения. Фотометрические определения в любой области спектра предполагают использование растворов сравнения – это растворители или растворы, содержащие все компоненты анализируемой пробы, кроме определяемого вещества. Фотометрические приборы сконструированы таким образом, что использование кювет с раствором сравнения позволяет шкалу оптических плотностей вывести на нуль и тем самым нивелировать поглощение, обусловленное стенками кюветы, растворителем и другими реактивами, используемыми для подготовки анализируемого образца. Благодаря высокой чувствительности УФ–спектрофотометрия широко используется в испытаниях твердых дозированных лекарственных препаратов на однородность дозирования. Это испытание является обязательным при содержании действующего вещества в дозе 0,05 г и менее. Для оценки такого количества требуются высокочувтствительные методы. Одним из них является УФ–спектрофотометрия. Высокая чувствительность метода позволяет также оценить количество действующего вещества, высвободившегося из лекарственной формы в растворяющую среду. Поэтому УФ–спектрофотометрия часто используется и при определении теста «Растворение», принятого ГФ для твердых лекарственных препаратов. Таким образом, одним из достоинств УФ–спектрофотометрии является ее универсальность, что позволяет использовать метод для решения различных аналитических задач. 1. Явление, лежащее в основе спектроскопических методов анализа. 2. Классификация спектроскопических методов анализа. Принцип классификации. 3. Природа поглощения в УФ– и ИК– областях спектра. 4. Основной закон светопоглощения. 5. Основные фотометрические величины. 6. Характеристика основных узлов спектрофотометров. Принципиальное отличие УФ–спектрофотометров и ИК– спектрометров. 7. Характеристика спектров поглощения в УФ– и ИК– областях спектра. 8. Сравнительная характеристика применимости УФ– и ИК– спектроскопии для решения фармацевтических задач. 9. Особенности подготовки пробы для спектрофотометрических определений в УФ– и ИК– областях спектра. 10.Применение УФ–спектрофотометрии для определения подлинности лекарственных веществ. 11.Возможности применения УФ–спектрофотометрии для определения примесей. Способы определения. 12.Применение УФ–спектрофотометрии в количественном анализе. Выбор условий количественного определения. Способы расчета результатов анализа. 13.Применение ИК–спектроскопии в фармацевтическом анализе. 1. В основе спектрофотометрического метода лежит а) избирательное поглощение электромагнитного излучения анализируемым веществом б) испускание электромагнитного излучения возбужденными атомами или молекулами в) отражение электромагнитного излучения анализируемым веществом 2. Поглощение электромагнитного излучения веществом зависит от а) интенсивности светового потока б) природы вещества в) толщины поглощающего слоя г) содержания вещества в анализируемом растворе 3. Установите соответствие электромагнитного излучения 4. Спектр поглощения 1) в УФ – области представляет собой а) графическую зависимость оптической плотности (D) или молярного коэффициента поглощения () от длины волны () падающего света б) графическую зависимость пропускания (Т) от частоты (), выраженной в обратных сантиметрах 5. Картина спектра 1) в УФ – области зависит от а) массы атомов и действующих между ними сил б) числа атомов и числа образованных между ними связей в) наличия в структуре системы сопряженных связей 6. Полосы поглощения в спектре 1) в УФ – области характеризуются а) расположением аналитических длин волн max, min б) положением в аналитической области спектра всего набора полос поглощения в) интенсивностью поглощения, выраженной через удельный показатель поглощения (Е1см) г) относительной интенсивностью, характеризуемой как малой, средней и высокой степени 7. Установите соответствие 1) область 1300 - 400 см 1 а) характеристика ядерного скелета 2) область 4000 - 1300 см 1 молекулы в целом 8. Более селективным и информативным для целей определения подлинности лекарственных средств является а) спектрофотометрия в УФ–области б) спектрофотометрия в ИК–области 9. Идентификация лекарственного вещества по ИК – спектрам может быть проведена а) по совпадению полос поглощения и относительной интенсивности со спектром стандартного образца б) по совпадению полос поглощения и относительной интенсивности с рисунком спектра, приведенным в ФС в) по положению и интенсивности аналитических длин волн, регламентированных в ФС 10. При испытании на подлинность лекарственных веществ УФ– спектрофотометрический метод рассматривается как а) основной б) дополнительный Определение подлинности лекарственных веществ УФ– 11. спектрофотометрическим методом может быть осуществлено а) по спектральной кривой б) по калибровочному графику в) по величине удельного показателя поглощения при аналитической длине волны 12. Чувствительность определения выше, а погрешность измерения величины поглощения меньше а) в УФ–области б) в ИК–области 13. В количественном анализе лекарственных веществ используется а) спектрофотометрия в УФ–области б) спектрофотометрия в ИК–области 14. спектрофотометрического определения предполагает а) взятие макронавески лекарственного вещества с последующим ее растворением и разбавлением соответствующим растворителем с использованием мерных колб б) растирание лекарственного вещества с вазелиновым маслом или другой жидкостью и помещение полученной суспензии между двумя пластинками из калия бромида в) растирание лекарственного вещества с калия бромидом и последующее прессование 15. Выбор концентрации раствора анализируемого вещества в УФ– спектрофотометрических определениях осуществляют а) по спектральной кривой б) по калибровочному графику в) исходя из концентрации стандартного раствора 16. В методике количественного определения лекарственных веществ УФ – спектрофотометрическим методом должны быть регламентированы а) величина макронавески б) мерная посуда для разведения навески в) концентрация раствора анализируемого вещества г)концентрация стандартного раствора или способ его приготовления д) аналитическая длина волны е) раствор сравнения 17. В более длинноволновой части спектра расположены полосы поглощения S NH N S NH N18. Отличить лекарственные вещества возможно с применением метода а) спектрофотометрия в УФ–области б) спектрофотометрия в ИК–области 19. Для двух производных 5 – нитрофурана полосы поглощения в УФ– области спектра а) позволяют отличить лекарственные вещества б) не позволяют отличить лекарственные вещества 20. Использование УФ–спектрофотометрического метода в анализе глюкозы обосновано с целью а) определение подлинности глюкозы б) определения примеси гидроксиметилфурфурола в) количественного определения глюкозы 21. Для двух лекарственных веществ из класса антибиотиков более специфичной является а) область «отпечатка пальцев» в ИК–спектре б) характеристические полосы поглощения ИК–спектра 2. б, в, г 9. а, б 10. б 11. а, в 12. а 13. а 14. а 15. б, в 16. а, б, г, д, е 17. б 18. б 19. а 20. б 21. б 1. УФ–спектр 0,002 % раствора дибазола в спирте 95% в области от 225 нм до 300 нм имеет максимумы при длинах волн 244 ± 2 нм;275 ± 1 нм; 281 ± 1 нм и минимумы при длинах волн 230 ± 2 нм; 253 ± 2 нм; 279 ± 1 нм. Как приготовить спиртовой раствор дибазола и получить его спектр? 2. Удельный показатель поглощения фурацилина в спиртовом растворе при = 365 нм составляет 850 – 875. Для определения удельного показателя аналитик приготовил 0,0005% раствор фурацилина. хлороводородной при = 243 нм имеет удельный показатель поглощения E11см = 542,5. Для определения показателя аналитик приготовил 0,001 % раствор кислоты аскорбиновой по следующей методике: около 0,05 г (точная навеска) кислоты аскорбиновой поместил в мерную колбу вместимостью 100 мл и растворил в 0,001 М растворе кислоты хлороводородной, довел объем раствора до метки. 2 мл полученного раствора разбавил растворителем в мерной колбе вместимостью 100 мл, получил в итоге 0,001% раствор. Проверьте правильность расчета концентрации раствора и оцените методику приготовления раствора с позиции метрологии. 4. Аналитик приготовил 0,001% раствор папаверина гидрохлорида, используя в качестве растворителя 0,1 М раствор кислоты хлороводородной. Измерил на приборе оптическую плотность приготовленного раствора при = 310 нм в кювете с толщиной слоя 1 см относительно растворителя. Оптическая плотность раствора составила D = 0,23. Затем по формуле рассчитал удельный показатель поглощения: В соответствии с НД удельный показатель должен быть 211 – 220. На основании полученных данных аналитик сделал заключение о несоответствии лекарственного вещества требованиям НД по показателю E11см. Оцените действия аналитика. аналитическими химическими реакциями. С кислотой серной концентрированной получают оксониевую соль ярко–желтого цвета. Реакцией с раствором серебра нитрата в азотнокислой подтверждают по температуре плавления. При подготовке нового проекта ФСП было принято решение о применении спектральных характеристик димедрола вместо аналитических реакций. В раздел «Испытание на подлинность» было внесено следующее изменение: УФ–спектр 0,05% раствора димедрола в спирте 95% в области от 230 нм до 280 нм имеет максимумы при длинах волн 253 ± 2 нм; 258 ± 2 нм; 264 ± 2 нм и минимумы при длинах волн Является ли принятое решение правильным? 6. При разработке нового проекта НД на кислоту аскорбиновую спектральные характеристики вещества, полученные методами УФ– и ИК–спектроскопии. спектроскопии и аналитических химических реакций. ИК–спектр новокаина, полученный в таблетках с калия бромидом в области от 4000 до 600 см 1, должен иметь полное совпадение полос поглощения с полосами поглощения прилагаемого спектра. Аналитические химические реакции подтверждают присутствие в структуре новокаина первичной ароматической аминогруппы и иона хлора. новокаина на подлинность. 8. Примесь адренолона в лекарственном веществе адреналина гидротартрат определяют спектрофотометрическим методом. В хлороводородной при = 310 нм в кювете с толщиной слоя 10 мм не должна превышать 0,2. Аналитик приготовил 0,2% раствор лекарственного вещества и измерил его оптическую плотность, соблюдая условия, указанные в НД. Оптическая плотность анализируемого вещества составила 0,26. При повторении анализа были получены аналогичные результаты. На основании полученных данных аналитик сделал заключение о несоответствии лекарственного вещества требованиям НД по содержанию примеси адренолона. 9. В проект ФСП на таблетки кислоты ацетилсалициловой 0,5 г в раздел «Испытание на подлинность», наряду с аналитическими реакциями, были включены спектральные характеристики спектрофотометрическим методом. Этот же метод рекомендован для определения теста «Растворение» и количественного анализа. 10.Количественное определение субстанции рибофлавина, согласно ФС, проводят спектрофотометрическим методом по методике: около 0,07 г рибофлавина (точная навеска) помещают в мерную колбу вместимостью 500 мл, прибавляют 5 мл воды и перемешивают до полного увлажнения пробы. Прибавляют по каплям (не более 5 мл) 1 М раствор натрия гидроксида и перемешивают до полного растворения пробы. Сразу же приливают 100 мл воды и 2,5 мл кислоты уксусной ледяной, перемешивают и доводят объем раствора водой до метки. 20 мл этого раствора переносят в мерную колбу вместимостью 200 мл, прибавляют 3,5 мл 0,1 М раствора натрия ацетата и доводят объем раствора водой до метки. Измеряют оптическую плотность полученного раствора при = 444 нм в кювете с толщиной слоя 10 мм. D – оптическая плотность испытуемого раствора; а – навеска рибофлавина в г; 328 – удельный показатель поглощения при 444 нм. рибофлавина по удельному показателю поглощения. Проверьте правильность расчета навески. Количественное определение раствора дибазола 1% для 11. инъекций проводят в соответствии с НД спектрофотометрическим методом по следующей методике: 2 мл препарата помещают в мерную колбу вместимостью 100 мл, доводят объем раствора спиртом 95% до метки и перемешивают. вместимостью 50 мл, прибавляют 30 мл спирта 95%, 1 мл 0,1 М раствора натрия гидроксида, доводят объем раствора спиртом до полученного раствора на спектрофотометре при = 244 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют спирт 95%. Параллельно измеряют оптическую плотность раствора стандартного образца (РСО) дибазола. 1 мл раствора РСО содержит около 0,00002 г дибазола. Проверьте расчеты навески препарата дибазола. 12.В соответствии с ФСП количественное определение таблеток пикамилона 20 мг проводят УФ–спектрофотометрическим методом по методике: около 0.08 г (точная навеска) порошка растертых таблеток количественно переносят с помощью воды в мерную колбу вместимостью 500 мл, доводят объем раствора водой до метки, перемешивают и фильтруют через бумажный фильтр (красная лента). Измеряют оптическую плотность полученного раствора на спектрофотометре в максимуме поглощения при длине волны ± 2 нм в кювете с толщиной слоя 10 мм. Параллельно проводят измерение оптической плотности раствора стандартного образца пикамилона. В качестве раствора сравнения используют воду. Правильно ли выбран метод количественного определения? 1. Для приготовления 0,002% спиртового раствора дибазола необходимо 0,2 г дибазола растворить в мерной колбе вместимостью мл в спирте 95%, довести объем раствора до метки. Получится 0,2% раствор, который необходимо разбавить в 100 раз. Для этого 1 мл приготовленного раствора помещают в мерную колбу вместимостью мл и доводят спиртом до метки. Затем измеряют на спектрофотометре оптическую плотность 0,002% раствора дибазола в кювете с толщиной слоя 10 мм относительно растворителя в области от 225 нм до 300 нм через 5нм, а вблизи максимумов и минимумов через 1 нм. По полученным значениям строят спектральную кривую зависимости оптической плотности (D) от длины волны (). На спектральной кривой отмечают длины волн, соответствующие максимальному и минимальному поглощениям. Они должны соответствовать длинам волн, приведенным в НД. Задача значительно облегчается при работе на современных спектрофотометрах с автоматическим устройством для записи спектров. 2. Удельный показатель поглощения – это поглощение 1% раствора при толщине слоя 1 см. Данный показатель рассчитывают по формуле: E1 см фурацилина составляет 850 – 875. Это означает, что его 1% раствор имеет оптическую плотность D = 850 – 875. Такую плотность раствора практически невозможно измерить на спектрофотометре, так как его шкала градуирована от 0 до 2. Причем, наименьшая погрешность градуировки находится в области 0,3 – 0,8. А оптимальная для измерения оптическая плотность составляет D = 0,43. Поэтому готовят испытуемый раствор такой концентрации, чтобы его оптическая плотность была близка к величине 0,43. Таким образом, расчеты аналитика верны. 3. Концентрацию раствора кислоты аскорбиновой для определения удельного показателя поглощения E11см рассчитывают по формуле: Аналитик приготовил 0,001% раствор вместо 0,0008%. Это вполне допустимо, так как приготовленный раствор будет иметь оптическую плотность: Такая плотность входит в рекомендуемый для измерения интервал оптических плотностей 0,3 – 0,8. Следовательно, аналитик правильно метрологии приготовил раствор недостаточно точно, взяв навеску вещества, равную 0,05 г. Для обеспечения точности взвешивания лучше брать навеску вещества как можно больше, в крайнем случае, равную 0,1 г. Из нее следует приготовить вначале 0,1% раствор, используя мерную колбу на 100 мл, а затем разбавить его в 100 раз для получения раствора с требуемой концентрацией 0,001%. Для этого можно взять 2 мл 0,1% раствора и мерную колбу вместимостью 200 мл. 4. Аналитик сделал необоснованное заключение. Он приготовил раствор низкой концентрации (0,001%). При измерении оптической плотности (D) такого раствора была допущена значительная ошибка, так как D = 0,23 не соответствует оптимальному значению D = 0,43. Неточность измерения оптической плотности отразилась на расчетах удельного показателя поглощения. приготовить новый раствор с концентрацией 0,002%, измерить его поглощения и только затем сделать заключение. 5. Решение об установлении подлинности димедрола только на основании его УФ–спектра является необоснованным. УФ–спектр димедрола характеризует в структуре вещества только ароматических кольца: Подобные хромофорные группы встречаются в ряде лекарственных веществ (эфедрина г/хл, атропина сульфат и т.д.). Поэтому УФ–спектры вещества не позволяют получить надежную информацию о его подлинности. Испытание на подлинность необходимо дополнить аналитическими химическими реакциями, подтверждающими другие структурные фрагменты димедрола, в частности простую эфирную связь и ион хлора. спектрофотометрического методов является рациональным при оценке подлинности димедрола. 6. Методы УФ– и ИК– спектроскопии обеспечивают надежность испытания кислоты аскорбиновой на подлинность. Поэтому аналитические химические реакции можно исключить. Принятые НД реакции, как правило, подтверждают присутствие в структуре кислоты аскорбиновой ен–диольной группировки, обусловливающей восстановительные свойства вещества. Однако в структуре вещества имеются также первичная и вторичная спиртовые группы, внутренняя сложноэфирная группировка, которые не оцениваются химическим методом. Только ИК–спектр кислоты аскорбиновой дает полную информацию о структуре вещества по наличию характеристических полос поглощения енольных и спиртовых ОН – групп, двойной связи в кольце и лактонной группировки, а также по набору полос поглощения в области «отпечатков пальцев». Достоверность обеспечивается сравнением спектра аскорбиновой кислоты со спектром ее стандартного образца или рисунком спектра. УФ–спектр кислоты аскорбиновой отражает присутствие в структуре только сопряженных двойных связей. Поэтому УФ–спектроскопия является дополнительным методом, а ИК–спектроскопия – главным методом в испытаниях на подлинность. Таким образом, предложение аналитика о применении комплекса методов УФ– и ИК– спектроскопии в испытании кислоты аскорбиновой на подлинность является обоснованным. 7. Комплекс испытаний новокаина на подлинность с применением ИК–спектроскопии и химического метода является научнообоснованным и рациональным. ИК–спектроскопия является специфическим методом функционального анализа, позволяющим обнаружить в структуре новокаина все функциональные группы: первичную ароматическую аминогруппу, сложноэфирную группу, катион замещенного аммония, по наличию в ИК–спектре характеристических полос поглощения в области 3500 – 1300 см 1. Область скелетных колебаний (ниже 1300 см 1) характеризуется множеством полос поглощения и является сугубо индивидуальной для новокаина. Аналитической реакцией доказывают присутствие иона хлора, азокрасителя является групповой для ароматических аминов и позволяет отнести лекарственное вещество к группе местных анестетиков. 8. При определении примеси адренолона спектрофотометрическим методом необходимо иметь в виду, что способ определения примеси по объясняется тем, что абсолютное значение оптической плотности плохо воспроизводится на разных приборах. Поэтому целесообразно определять отношение оптических плотностей при разных длинах волн ()и нормировать относительную величину, которая более или менее постоянна и лучше воспроизводится на разных приборах. Для обоснованного заключения о содержании примеси адренолона аналитик должен быть уверен в правильности показаний спектрофотометра. Поэтому приборы в лаборатории должны быть поверены органами метрологической службы. Если приборы поверены, то можно измерить оптическую плотность испытуемого раствора на разных спектрофотометрах и сопоставить полученные значения. При воспроизводимости величины D = 0,26 на разных приборах можно уверенно утверждать, что адреналина гидротартрат не соответствует требованиям НД по содержанию примеси адренолона. 9. Выбор УФ–спектрофотометрического метода для испытания таблеток ацетилсалициловой кислоты на подлинность и определения теста «Растворение» является научнообоснованным. УФ–спектр ацетилсалициловой кислоты дополняет аналитические реакции на подлинность, так как полоса поглощения в спектре свидетельствует об ароматической природе вещества. Вполне логично использование метода и при определении теста «Растворение», показывающего количество вещества, перешедшего в растворяющую среду из лекарственной формы за 45 мин при 37O C. Для испытания используют прибор «Вращающаяся корзинка». В корзинку помещают одну таблетку и опускают в среду растворения – ацетатный буферный раствор с рН 4,5 и объемом 700 мл. Через 45 мин отбирают пробу и определяют содержание ацетилсалициловой кислоты. Поскольку количество действующего вещества в среде растворения будет составлять примерно: потребуется высокочувствительный метод для его определения в пробе. Таким методом является УФ–спектрофотометрия. Для количественных целей лучше использовать титриметрический метод, являющийся абсолютным и не требующий сравнения со стандартным образцом. Дозировка таблеток ацетилсалициловой кислоты, равная 0,5 г, позволяет использовать данный метод. высокочувствительные методы. Поэтому определение субстанций лекарственных веществ, как правило, проводят посредством титрования. Однако субстанция рибофлавина не имеет аналитических реакций, удовлетворяющих требованиям титриметрии. По этой причине для количественного определения рибофлавина выбирают не химические, а спектрофотометрический метод, так как рибофлавин интенсивно поглощает в УФ– и видимой областях спектра. количественных целей является обоснованным. Однако приведенный в ФС способ определения по удельному показателю поглощения требует совершенствования, так как сопровождается значительной погрешностью. Более правильным и точным является способ сравнения со стандартным образцом категории ГСО. Расчет навески рибофлавина проводят по удельному показателю поглощения E11см = 328. процентах, принимая во внимание оптимальное значение оптической плотности D = 0,43: увеличивают, затем используют прием разведения. По методике ФС навеску увеличивают в 5000 раз и получают Таким образом, навеска рибофлавина рассчитана правильно. Однако с позиции метрологии лучше микронавеску увеличить в 8000 раз и получить навеску, равную 0,1 г. 11. Выбор спектрофотометрического метода для количественного научнообоснованным. Содержание действующего вещества в препарате невысокое, поэтому для его определения требуется высокочувствительный метод, каковым является УФ–спектрофотометрия. Кроме того, дибазол по химической структуре относится к гетероароматическому ряду и активно поглощает УФ–излучение, что позволяет использовать метод для количественных целей. Спектрофотометрический метод является относительным и требует сравнения со стандартным образцом. Анализируемый раствор и раствор стандартного образца готовят примерно одинаковой концентрации. Концентрация раствора стандартного образца указывается в НД. Это является основанием для расчета навески образца. В нашем случае концентрация раствора рабочего стандартного образца равна 0,00002 г/мл. Испытуемый раствор необходимо приготовить с таким же содержанием дибазола. СХ = СС.О = 0,00002 г/мл Затем делают пересчет на раствор дибазола: Так как навеска мала, ее увеличивают в 1000 раз и используют прием разведения: Таким образом, навеска препарата дибазола рассчитана правильно. 12. Пикамилон – лекарственное вещество гетероциклического ряда, аминомасляной кислот: Применяется как ноотропное средство в форме таблеток с дозировкой 20 мг. В структуре вещества есть пиридиновый хромофор, сопряженный с амидной группой и обусловливающий поглощение пикамилона в УФ–области. Поэтому выбор спектрофотометрического метода для количественных целей вполне обоснован. Кроме того, содержание действующего вещества в таблетках незначительно (20 мг), поэтому требуется высокочувствительный метод, каким является УФ– спектрофотометрия. Не вызывает сомнение и выбор воды в качестве растворителя, так как действующее вещество, являясь натриевой солью карбоновой кислоты, растворяется в воде. Предусмотрена предварительная обработка с целью отделения вспомогательных веществ, нерастворимых в воде и мешающих вследствие этого определению. стандартного образца обеспечивает правильность и точность анализа. Недостатком предлагаемой методики является то, что анализируемая навеска таблеточной массы мала (0,08 г). С позиции метрологии лучше работать с навеской 0,1 г и более. Чем больше навеска, тем меньше погрешность взвешивания. Увеличение навески в данном случае вполне возможно, поскольку нет необходимости в экономии анализируемого материала, так как навеску берут из 20 таблеток, растертых в порошок. Дайте обоснование использованию УФ – спектрофотометрического количественного анализа с полной расчетной аргументацией. При выполнении задания используйте алгоритм и пример решения задачи. 1. Раствор анаприлина 0,25 % в ампулах CCO 0,00002 г мл 2. Раствор кислоты никотиновой 1% в ампулах CCO 0,00001 г мл 4. Мазь гидрокортизоновая глазная 0,5 % - 3,0 CCO 0,00001 г мл 7. Суппозитории ректальные с диклофенаком натрия 50 и 100мг 9. Таблетки кортизона ацетата 0,025 г 10. Таблетки преднизолона 0,001 г 11. Таблетки этинилэстрадиола 0,00001 г Средняя масса 0,056 г 12. Таблетки прегнина 0,01 г Средняя масса 0,108 г 13. Таблетки пиридоксина 0,002 г Средняя масса 0,205 г 14. Таблетки тиамина хлорида 0,002 г Средняя масса 0,212 г к составлению методики количественного анализа лекарственных средств УФ спектрофотометрическим методом 1. Обосновать выбор метода. 3. Решить вопрос о предварительной обработке. 4. Составить методики приготовления раствора испытуемого препарата и раствора стандартного образца. 5. Составить методику спектрофотометрического анализа. 6. Составить расчетную формулу содержания действующего вещества. Объектом анализа является раствор для инъекций с низким содержанием лекарственного вещества. Последнее обстоятельство требует использования в количественном анализе наиболее чувствительного метода. К таким методам относится УФ–спектрофотометрия. Кроме того, данный метод не требует трудоемких и длительных аналитических операций. спектрофотометрического метода возможно при наличии в его структуре системы сопряженных связей. электромагнитного излучения в УФ–области обусловлено наличием в спектрофотометрический метод. Расчет навески: отправным моментом для расчета навески лекарственной формы при ее спектрофотометрическом анализе является которого будет осуществляться определение. В условии задачи приведена концентрация раствора рабочего стандартного образца (РСО) CCO 0,00005 г мл Анализируемый раствор обеспечения точности анализа используют макронавеску и мерную посуду для ее разведения. Анализируемый раствор является 0,1%, следовательно, можно составить пропорцию: 0,1 г адреналина - 100 мл раствора Рассчитанную навеску можно увеличить в 100 раз. Это позволит использовать для ее измерения пипетку объемом 5 мл, а для последующего разведения мерную колбу вместимостью 100 мл. осуществляется в 0,1 М растворе кислоты хлороводородной. Выбор растворителя обусловлен обеспечением стабильности лекарственного вещества в его растворе. дополнительных аналитических операций по извлечению вещества из его лекарственной формы не требуется. Методика: 5 мл раствора адреналина гидрохлорида помещают в мерную колбу вместимостью 100 мл и доводят объем раствора 0,1 М раствором кислоты хлороводородной до метки. Измеряют оптическую плотность полученного раствора на спектрофотометре при аналитической длине волны в кювете с толщиной слоя 10 мм. Параллельно измеряют оптическую плотность раствора рабочего стандартного образца (РСО) адреналина гидрохлорида. В качестве раствора сравнения применяют 0,1 М раствор кислоты хлороводородной. Расчет результатов. DХ; DСО – значения оптических плотностей испытуемого раствора и раствора РСО адреналина гидрохлорида соответственно. лекарственных веществ. М.: «Медицина», 1978. – 248 с. «Медицина», 1975. – 151 с. Беликов В.Г. Фармацевтическая химия. В 2 ч. / В. Г. Беликов. – Пятигорск, 2003. – 720 с. Государственная фармакопея СССР. / МЗ СССР. – 11 – е издание. – М.: Медицина, 1987. – Вып. 1. – 336 с. Государственная фармакопея СССР. / МЗ СССР. – 11 – е издание. – М.: Медицина, 1989. – Вып. 2. – 400 с. Государственная фармакопея Российской Федерации / 12 – издание. – «Издательство «НЦЭСМП», 2008. – 704 с. Казицина Л.А., Куплетская Н.Б. Применение УФ –, ИК –, ЯМР – и масс – спектроскопии в органической химии. М., Изд. Моск. ун – та, 1979. – 240 с. Методы анализа лекарств/Н.П. Максютина и др.- Киев: Здоровья,1984. – 224 с. Основы аналитической химии. В 2 кн..Кн. 2. Методы Ю.А.Золотова. – 2-е изд. – М.: Высш. шк.; 2002. – 494 с. Отто М. Современные методы аналитической химии. / М. Отто. – М.: Техносфера, 2006. – 416 с. Фармацевтическая химия: Учебное пособие / Под ред. А.П. Арзамасцева. – М.: ГЭОТАР – МЕД, 2004. – 640 с. ФСП 42 – 0035225102 Кислота аскорбиновая. Введение 1. Характеристика спектроскопических методов анализа 2. Основной закон светопоглощения Фотометрические величины............... 3. Характеристика спектрофотометров 4. Характеристика спектров поглощения 5. Подготовка пробы для фотометрических определений 6. Сравнительная характеристика абсорбционных методов 7. Применение спектрофотометрии в фармацевтическом анализе.............. 7.1. Применение ИК – спектроскопии в анализе лекарственных средств 7.2. Применение УФ – спектрофотометрии в анализе лекарственных средств «ГОУ ВПО КЕМЕРОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кафедра аналитической химии ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ Методические указания к выполнению лабораторных работ по курсу Аналитическая химия для студентов 2 курса химического факультета Кемерово 2004 2 Составители: доценты кафедры аналитической химии к.х.н. Шрайбман Г. Н., к.х.н. Серебренникова Н. В., ст. преподаватель кафедры аналитической химии Халфина П.Д. Потенциометрическое титрование: методические указания к выполнению лабораторных работ по...» «МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОУ ВПО ОРЛОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ И.Н. Загурская, Д.В. Цымай, И.Н. Загурский НЕОРГАНИЧЕСКАЯ ХИМИЯ УЧЕБНОЕ ПОСОБИЕ Орел 2008 2 УДК 546 (075) ББК 24.1я7 З-14 Рецензенты: Заведующий кафедрой Химия Орловского государственного технического университета, доктор технических наук, профессор, С.А. Куценко; Кандидат технических наук, доцент кафедры Химия Орловского государственного института...» «Обложка: © П. Ван Пенеен /ЮНЕП / Still Pictures Свалка химических отходов, Канада. Опасные химические вещества могут существовать в окружающей среде десятилетиями, накапливаясь в пищевой цепи, и могут переноситься далеко от первоначального места. Они представляют серьезную угрозу для рабочих, наносят вред нервной и иммунной системе, вызывают рак и нарушают репродуктивную функцию, а также оказывают негативное воздействие на развитие ребенка. Спасение жизней и защита окружающей среды посредством...» «МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ СЕВЕРО-КАВКАЗСКАЯ ГОСУДАРСТВЕННАЯ ГУМАНИТАРНО-ТЕХНОЛОГИЧЕСКАЯ АКАДЕМИЯ А. Д. Пешков А. Х. Бостанов З. У. Гочияева СЕРТИФИКАЦИЯ И ХИМИЧЕСКИЙ КОНТРОЛЬ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПРОДУКЦИИ Методические указания к практическим занятиям студентам направления подготовки 110900.62 Технология производства и переработки сельскохозяйственной продукции...» «МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ НОВОСИБИРСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Факультет естественных наук Кафедра химии окружающей среды РОССИЙСКАЯ АКАДЕМИЯ НАУК ИНСТИТУТ ПРИРОДНЫХ РЕСУРСОВ, ЭКОЛОГИИ И КРИОЛОГИИ СИБИРСКОГО ОТДЕЛЕНИЯ РАН А. Б. Птицын ГЕОХИМИЯ БИОСФЕРЫ Учебное пособие Новосибирск 2013 УДК 577.1 + 577.4 ББК Е072,73-2 + Е081,73-2 П 94 Птицын А. Б. Геохимия биосферы: Учеб. пособие / Новосиб. гос. ун-т. Новосибирск, 2013. 238 с. ISBN 978-5-4437-0186-...» «БЕЗОПАСНОСТЬ ЖИЗНЕДЕЯТЕЛЬНОСТИ ВОПРОСЫ И ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ Издательство ТГТУ Министерство образования и науки Российской Федерации ГОУ ВПО Тамбовский государственный технический университет БЕЗОПАСНОСТЬ ЖИЗНЕДЕЯТЕЛЬНОСТИ ВОПРОСЫ И ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ Методические указания для студентов всех специальностей и форм обучения Тамбов Издательство ТГТУ 2010 УДК 331.45(075) ББК Ц903я У Р еце нз е нт Заведующий кафедрой Химия, доктор химических наук, профессор А.Б. Килимник У76...» « образования Санкт-Петербургская государственная лесотехническая академия им. С. М. Кирова КАФЕДРА ЭКОЛОГИИ И ПРИРОДОПОЛЬЗОВАНИЯ ЗЕМЛЕДЕЛИЕ С ОСНОВАМИ АГРОХИМИИ И ПОЧВОВЕДЕНИЯ Методические указания и контрольные задания для студентов специальности 060800 “Экономика и управление АПК” заочной формы обучения Сыктывкар 2004 Рассмотрены и...» «ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ САМАРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ХИМИЧЕСКИЙ ФАКУЛЬТЕТ Кафедра органической химии Г.Ф. Названова ОРГАНИЧЕСКАЯ ХИМИЯ Методические указания Издательство Универс-групп 2005 Печатается по решению Редакционно-издательского совета Самарского государственного университета УДК 547.1 ББК 24.2 Н 19 Названова Г.Ф. Н 19 Органическая химия: Методические указания. Самара. Изд-во...» «База нормативной документации: www.complexdoc.ru РОССИЙСКОЕ АКЦИОНЕРНОЕ ОБЩЕСТВО ЭНЕРГЕТИКИ И ЭЛЕКТРИФИКАЦИИ ЕЭС РОССИИ Департамент научно-технической политики и развития МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ХИМИЧЕСКОМУ КОНТРОЛЮ КОРРОЗИОННЫХ ПРОЦЕССОВ ПРИ ФИЛЬТРАЦИИ ВОДЫ ЧЕРЕЗ БЕТОННЫЕ И ЖЕЛЕЗОБЕТОННЫЕ ГИДРОТЕХНИЧЕСКИЕ СООРУЖЕНИЯ РД 153-34.2-21.544-2002 ОАО ВНИИГ им. Б.Е. Веденеева Санкт-Петербург 2003 СОДЕРЖАНИЕ 1. ОБЩИЕ ПОЛОЖЕНИЯ 1.1. Назначение и область применения 1.2. Нормативные ссылки 1.3....» «МИНОБРНАУКИ РОССИИ ФГБОУ ВПО Уральский государственный лесотехнический университет Б.П. Середа Л.С. Молочников Л.В. Демидова С.В. Целищева ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ ЭЛЕМЕНТЫ ТЕОРИИ, СПРАВОЧНЫЕ ДАННЫЕ, ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ Под редакцией проф. Б.П. Середы и проф. Л.С. Молочникова 2-е издание, переработанное и дополненное Рекомендовано учебнометодическим объединением по образованию в области лесного дела в качестве учебного пособия для студентов высших учебных заведений...» «Министерство образования Российской Федерации Казанский государственный технологический университет СПЕКТРОФОТОМЕТРИЧЕСКИИ ЭКСПРЕСС-АНАЛИЗ НА РАЗДЕЛЬНОЕ СОДЕРЖАНИЕ В ГАЗОВОЙ СМЕСИ ОКСИДА И ДИОКСИДА АЗОТА Методические указания 2001 Министерство образования Российской Федерации Казанский государственный технологический университет СПЕКТРОФОТОМЕТРИЧЕСКИЙ ЭКСПРЕСС-АНАЛИЗ НА РАЗДЕЛЬНОЕ СОДЕРЖАНИЕ В ГАЗОВОЙ СМЕСИ ОКСИДА И ДИОКСИДА АЗОТА Методические указания Казань 2001 Составители: проф....» «МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ НИЛ ГАММЕТТ УФИМСКОГО ГОСУДАРСТВЕННОГО АВИАЦИОННОГО ТЕХНИЧЕСКОГО УНИВЕРСИТЕТА В.П. МАЛИНСКАЯ Р.М. АХМЕТХАНОВ КОЛЛОИДНАЯ ХИМИЯ В ВОПРОСАХ И ОТВЕТАХ Учебное пособие Уфа РИЦ БашГУ 2013 УДК 544.77(075.32) Издание осуществлено при финансовой поддержке РФФИ (проект 12-01моб-г), при поддержке гранта правительства РФ по договору №11.G34.31.0042 и за счет внебюджетных средств БашГУ. Издание подготовлено в рамках...» «МУК 4.1.1247-03 УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации, Первый заместитель Министра здравоохранения Российской Федерации Г. Г. Онищенко 16 марта 2003 г. Дата введения – 1 июля 2003 г. 4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ Определению остаточных количеств бентазона в семенах и масле сои методом высокоэффективной жидкостной хроматографии Методические указания МУК 4.1.1247- 1. Вводная часть Фирма-производитель: Август. Торговое наименование: Корсар. Действующее...» «Донецкий национальный медицинский университет им. М.Горького. Кафедра медицинской химии. МЕТОДИЧЕСКИЕ УКАЗАНИЯ к практическим занятиям по биоорганической химии (для студентов первого курса стоматологического факультета). Донецк - 2011 Методические указания подготовили: -зав. кафедрой доцент Рождественский Е.Ю. -доценты: Сидун М.С., Селезнева Е. В. -ст. преподаватель Павленко В.И. -ассистенты кафедры: Бусурина З.А., Сидоренко Л.М., Игнатьева В.В., Бойцова В.Е. -2Вступление. Целью развития...» «Утверждаю Главный государственный санитарный врач Российской Федерации, Первый заместитель Министра здравоохранения Российской Федерации Г.Г.ОНИЩЕНКО от 16 мая 2003 года Дата введения – с момента утверждения 4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ ИЗМЕРЕНИЕ МАССОВЫХ КОНЦЕНТРАЦИЙ ВАНАДИЯ, ВИСМУТА, ЖЕЛЕЗА, КОБАЛЬТА, МАРГАНЦА, МЕДИ, НИКЕЛЯ, СВИНЦА, ХРОМА, ЦИНКА РЕНТГЕНОФЛУОРЕСЦЕНТНЫМ МЕТОДОМ В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ МЕТОДИЧЕСКИЕ УКАЗАНИЯ МУК 4.1.1354- 1. Методические указания подготовлены:...» «ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования УХТИНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ КОРРОЗИЯ МЕТАЛЛОВ Методические указания к лабораторному практикуму по дисциплине Химия Ухта 2008 УДК 546(075) М – 38 Мартынова, В.Ф. Коррозия металлов [Текст]: метод. указания к лабораторному практикуму по дисциплине Химия/ В.Ф. Мартынова. – Ухта: УГТУ, 2008. – 12 с.: ил. Методические указания предназначены для выполнения...» « учреждения высшего профессионального образования Санкт-Петербургский государственный лесотехнический университет имени С. М. Кирова Кафедра целлюлозно-бумажного производства, лесохимии и промышленной экологии Н. Ф. Пестова СОПРОДУКТЫ ЦЕЛЛЮЛОЗНО-БУМАЖНОГО ПРОИЗВОДСТВА Учебное пособие Утверждено учебно-методическим советом Сыктывкарского лесного...» «ФЕДЕРАЛЬНОЕ АГЕНСТВО МОРСКОГО И РЕЧНОГОФЛОТА РФ МОРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ имени адмирала Г. И. Невельского Кафедра химии и экологии Методические указания для выполнения лабораторных работ по дисциплине Техническая химия для курсантов и студентов специальностей 18040365, 18010465, 15020565 и 19060265 Издание 2-е, переработанное и дополненное Составили: проф., д.х.н. Б.Б. Чернов доцент, к.х.н. Г.П. Щетинина Владивосток 2009 Позиция № 332 в плане издания учебной литературы на 2009 г....» «Федеральные клинические рекомендации по диагностике и лечению фенилкетонурии Москва 2013 2 Федеральные клинические рекомендации по диагностике и лечению фенилкетонурии Авторский коллектив: ГБУЗ Краевая клиническая больница №1 имени проф. С.В.Очаповского МЗ Краснодарского края. Кубанская межрегиональная медико-генетическая консультация: д.м.н. С.А. Матулевич, к.м.н. Т.А.Голихина. Детская психиатрическая больница №6. Московский центр неонатального скрининга: к.м.н. Е.В. Денисенкова. АНМО...» Восстановление клеток, поврежденных УФ ‑излучением, является сложнейшим процессом, совершенствующимся с момента зарождения живого. На ранних этапах развития жизни наличие интенсивного УФ - излучения, в том числе и коротковолнового (вследствие отсутствия атмосферных экранов), привело к развитию мощных, репарирующих УФ -повреждения, внутриклеточных систем, которые в настоящих условиях для большинства клеток многоклеточных животных являются избыточными. При достаточно низкой интенсивности облучения репарационные процессы в клетке успевают устранять возникающие повреждения раньше, чем их количество превысит некоторое "критическое" значение, приводящее к появлению нерепарабельных нарушений. Клеточные системы успевают закончить репарацию генома за время, измеряющиеся несколькими часами, но для отдельных, наиболее активных сайтов ДНК, репарация тиминовых димеров происходит значительно быстрее. Время, в течение которого внешние воздействия могут изменить интегральный ответ клетки на импульсное повреждающее воздействие, связано с процессами репарации. Для УФ ‑повреждённых кератиноцитов кожи это время (судя по результатам ингибиторного анализа) составляет десятки минут. Повреждающее воздействие можно считать "импульсным" (однократным) в том случае, если его длительность меньше времени, в течение которого определяется судьба повреждённой клетки. Есть основания считать, что для некоторых ответов клетки на УФ -повреждение это время измеряется секундами. Если по критерию МЭД закон взаимозаменяемости интенсивности и времени облучения для УФ ‑эритемы выполняется в интервале от долей до сотен секунд, то эритема от дозы, превышающей МЭД, возрастает с ростом интенсивности. Количественно это выражается в том, что при возрастании интенсивности облучения полным спектром лампы ПРК-2 на 3 порядка, тангенс угла наклона дозовой зависимости увеличивается более чем в 3 раза. Современные знания о клеточных механизмах позволяют утверждать, что, кроме репарации клетки, существует ещё один вариант физиологического ответа клетки на повреждение - апоптоз, который препятствует "патологической" гибели клетки по механизму некроза. Программа элиминации клетки механизмом апоптоза включается при невозможности полной репарации. Повреждение при этом не должно превысить порог, при котором происходит поломка программы апоптоза. В последнем случае гибель клетки происходит по механизму некроза с формированием воспалительной реакции. Для УФ ‑излучения в качестве поглощённой дозы традиционно измеряют энергию, падающую на единицу поверхности облучаемого объекта, то есть поверхностную плотность дозы. Это возможно по той причине, что наиболее биологически активная часть УФ ‑излучения поглощается поверхностными слоями кожи. В промежутке между дозами повреждения, приводящими клетку к "чистому" апоптозу или к некрозу, возможна (при дозе УФВ излучения около 350 Дж/м 2) реализация программы апоптоза с "изменённой морфологией" или "провоспалительного апоптоза", который происходит при модификации программы апоптоза, вероятно, тем же самым повреждающим воздействием, которое и вызвало апоптоз. Экспериментально провоспалительный апоптоз был обнаружен в работе (Caricchio R e.a., J Immunol. Dec 2003). Бимодальность действия УФ -излучения на кератиноциты (немонотонная дозовая зависимость апоптоза) показана также и в других работах. Но природа этих явлений не установлена. Наиболее вероятной представляется модель, согласно которой исход УФ облучения кератиноцитов кожи определяется количеством (долей) УФ - поврежденных митохондрий. Данные предположения подтверждаются особенностями дозозависимой кинетики двухкомпонентной УФВ -эритемы кожи. Опыты на культуре человеческих кератиноцитов показывают, что при УФС -облучении производится значительно большее количество фотопродуктов (CPDs и (6-4)PPs), а приблизительно равный апоптогенный эффект УФС и УФВ излучений обусловлен тем, что УФВ облучение активирует не только митохондриальный, но и caspase-8 зависимый путь активации апоптоза (Takasawa R e.a., PubMed - in process Oct 2005). Важнейшей задачей является исследование связи УФ -индуцированного апоптоза с эритемогенезом, но при этом следует учитывать особенности поглощения УФ излучения в различных слоях кожи. Установление связи УФ -индуцированного апоптоза с эритемогенезом позволит разработать неинвазивный метод диагностики параметров системы апоптоза. В настоящее время особое внимание должно уделяться разработке методов диагностики, основанных на анализе развивающихся во времени реакций систем организма на какое-либо (внешнее) воздействие. Разрабатываемый метод диагностики характеризуют дешевизна, неинвазивность, абсолютная стерильность и возможность оказывать физиологическое, строго дозированное тестирующее воздействие на кожные и другие покровы. Библиографическая ссылкаБондырев Ю.А. АНАЛИЗ ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ УФ ИЗЛУЧЕНИЯ КАК ТЕСТИРУЮЩЕГО ДИАГНОСТИЧЕСКОГО ВОЗДЕЙСТВИЯ // Современные проблемы науки и образования. – 2006. – № 2.;URL: http://science-education.ru/ru/article/view?id=183 (дата обращения: 05.01.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» Благодаря простоте аналитических операций и, в большинстве случаев, высокой чувствительности метод нашел широкое применение в фармацевтическом анализе. УФ-спектрофотометрия используется при установлении подлинности (идентификации), доброкачественности, количественном определении, как индивидуальных веществ, так и компонентов лекарственных форм; испытании по тестам “Растворение” и “Однородность дозирования”. Метод применяется на таких стадиях изучения лекарственных веществ и лекарственных форм как фармакокинетика, биодоступность, изучение стабильности и установление сроков годности. Испытание на подлинность лекарственных веществ. В основе этой стадии фармацевтического анализа лежат следующие приемы: а) нахождение в спектре λ max и λ min , характеризующих области максимального и минимального поглощения; б) вычисление отношения значений оптических плотностей исследуемого раствора при разных длинах волн; в) характеристика интенсивности поглощения по величине удельного показателя (Е); г) сравнение спектра анализируемого вещества со спектром стандартного образца этого же вещества. Во всех случаях необходимо получение спектра в условиях, приведенных в НД – растворитель, концентрация, интервал длин волн, размер (толщина) кюветы. Для случая (а) в полученном спектре находят λ max и λ min , сравнивают с такими же характеристиками, приведенными в НД – при идентичности веществ оба значения должны совпадать (табл.7). Удобным приемом при испытании на подлинность является определение отношения величин поглощения при двух максимумах. Это уменьшает влияние переменных характеристик прибора на испытание и исключает необходимость использования стандартного образца. Такой способ используют в случае анализа натрия пара-аминосалицилата натрия Таблица 7 Характеристика уф-спектров, используемая при идентификации некоторых лекарственных веществ в фармакопейном анализе
При испытании на подлинность часто рекомендуется рассчитать Ев максимуме поглощения (например, для левомицетина, адреналина, прогестерона) или сравнить найденное значение оптической плотности в определенном диапазоне длин волн со значениями, приведенными в НД. Так спектр поглощения раствора пиридоксина гидрохлорида в фосфатном буферном растворе (рН = 6,9) с концентрацией 0,5 мг/мл в области от 230 до 250 нм имеет максимумы при 254 и 324 нм, а оптическая плотность при этих максимумах равна соответственно 0,18 и 0,35. Некоторые испытания на подлинность с использованием УФ-спектрофотометрии требуют применение стандартных образцов (СО) лекарственных веществ. В этом случае проба СО должна быть приготовлена и одновременно определена в тех же условиях, что и испытуемое вещество. Так, УФ-спектр 0,0005% раствора этинитэстрадиола в спирте этиловом должен иметь максимумы и минимумы при тех же длинах волн, что и раствор СО одинаковой концентрации, соответствующие величины поглощения, рассчитанные на сухое вещество при λ max = 281 нм не должны отличаться более, чем на 3%. Такой прием обеспечивает более достоверные результаты, чем при анализе спектра только одного исследуемого соединения. УФ-спектрофотометрия является также одним из составных комплекса спектральных методов исследования новых биологически активных веществ. Определенные полосы поглощения в спектре могут указать на наличие в структуре этого соединения тех или иных функциональных групп, фрагментов структур (хромофоров). Этим объясняется сходство спектров веществ, содержащих фенильный радикал, например, эфедрина, димедрола, атропина, бензилпенициллина. Они имеют три максимума поглощения: 251, 257 и 263 нм (рис.7). Лекарственные вещества, содержащие замещенный ароматический радикал – адреналин, морфин, эстрадиол, левомицетин и др. – имеют в спектре один максимум около 260 нм, сопряженную еноновую систему в лекарственных веществах из группы кортикостероидов – около 238 нм (рис.8). У некоторых лекарственных веществ (производные барбитуровой кислоты, сульфаниламиды, фенолы, некоторые производные пурина и др.) характер спектра может изменяться в зависимости от рН раствора (рис. 9, 10, 11, 12, 14). При этом изменяется λ max (батохромное смещение), усиливается поглощение (увеличивается величина оптической плотности), наблюдается гиперхромный эффект. Кофеин не проявляет кислотных свойств, поэтому максимум поглощения у него в кислой и щелочной среде при одной и той же длине волны – 272 нм (рис. 13). То есть, УФ-спектрофотометрия может дать информацию об определенных свойствах исследуемого вещества. Одназначного вывода о структуре химического соединения с помощью УФ-спектрофотометрии сделать невозможно, так как интерпретация спектра затруднена из-за присутствия в молекуле более чем одного хромофора. Тем не менее метод позволяет определить некоторые группировки – хромофоры и сделать вывод о характере и степени сопряжения (с удлинением цепи сопряжения наблюдается смещение максимума поглощения в более длинноволновую область, рис.11).
УФ-спектрофотометрия используется для изучения свойств органических соединений: способности к образованию водородной связи, определения рК а кислот и оснований, определения состава и свойств комплексных соединений лекарственных веществ, изомерии. Цис- и транс- изомеры имеют отличные друг от друга спектры. Транс-форма обычно поглощает сильнее и полоса ее поглощения сдвинута в длинноволновую область; этот факт может служить доказательством изменения структуры в ходе реакции. Однако, УФ-спектры не дают каких-либо сведений о строении исследуемого вещества, т.к. они позволяют установить лишь наличие хромофоров и гетероатомов. Кроме того, УФ-спектрофотометрия дает прекрасную возможность для количественного анализа веществ, содержащих такие группировки. При испытании на доброкачественность (чистоту) используют те же характеристики, что и при идентификации. При наличии примесей может изменяться λ max , появляться дополнительные максимумы, изменяться интенсивность поглощения. Специфические примеси, присутствующие в лекарственных веществах, как правило, имеют близкое химическое строение с исследуемым веществом. Поэтому особый интерес представляют случаи, когда лекарственное вещество и его специфическая примесь поглощают при разных длинах волн. Например, λ max адреналина (Ι) располагается при 278 нм, а его специфическая примесь – адренолон (ΙΙ) имеет максимум поглощения при 310 нм.
Согласно требованию фармакопейной статьи, в 0,05% растворе адреналина, приготовленном для испытания на чистоту, оптическая плотность при 310 нм не должна превышать 0,1 (т.е. в адреналине допускается строго нормируемое содержание адренолона). Количественное определение. Принцип количественного определения методом УФ-спектрофотометрии заключается в следующем: навеску анализируемого образца (субстанция, лекарственная форма и др.) растворяют в подходящем растворителе, если необходимо, дополнительно готовят разведение полученного раствора и измеряют его оптическую плотность при длине волны, указанной в методике. Концентрацию (содержание) анализируемого вещества находят одним из описанных ранее способов (п. 1.2.3.4). В соответствии с современными требованиями для таблеток, драже, сухих лекарственных средств для инъекций и лекарственных веществ в капсулах с содержанием действующего вещества 0,05 г и менее обязательным является испытание на однородность дозирования, т.е. содержание вещества в каждой отдельной дозе. Для такой оценки, особенно в случае содержания действующего вещества в мг или его долях (таблетки клофелина содержат 0,075 и 0,15 мг действующего вещества) требуется применение высокочувствительного метода. Таким в большинстве случаев и является УФ-спектрофотометрия. Актуальным является исследование биодоступности лекарственных веществ. Определенной ее характеристикой является тест “Растворение” (ГФ ΧΙ, вып. 2, с.154). УФ-спектрофотометрия, отличающаяся, как правило, высокой чувствительностью является одним из наиболее часто используемых для этой цели методов (табл.8). Ниже приводятся методики анализа некоторых лекарственных веществ спектрофотометрическим методом в УФ-области, а в табл.8 приведен ряд примеров использования метода УФ-спектрофотометрии в фармакопейном анализе. Подробности Опубликовано 27.12.2019Дорогие читатели! Коллектив библиотеки поздравляет вас с Новым годом и Рождеством! От всей души желаем счастья, любви, здоровья, успехов и радости вам и вашим семьям! Тестовый доступ к ЭБС Ibooks.ruПодробности Опубликовано 03.12.2019Уважаемые читатели! До 31.12.2019 нашему университету предоставлен тестовый доступ к ЭБС Ibooks.ru , где вы сможете ознакомиться с любой книгой в режиме полнотекстового чтения. Доступ возможен со всех компьютеров сети университета. Для получения удалённого доступа необходима регистрация. «Генрих Осипович Графтио - к 150 - летию со дня рождения»Подробности Опубликовано 02.12.2019Уважаемые читатели! В разделе "Виртуальные выставки" размещена новая виртуальная выставка «Генрих Осипович Графтио». В 2019 году исполняется 150 лет со дня рождения Генриха Осиповича - одного из основателей гидроэнергетической отрасли нашей страны. Ученый-энциклопедист, талантливый инженер и выдающийся организатор, Генрих Осипович внес огромный вклад в развитие отечественной энергетики. Выставка подготовлена сотрудниками отдела научной литературы библиотеки. На выставке представлены труды Генриха Осиповича из фонда истории ЛЭТИ и публикации о нём. Ознакомиться с выставкой Вы можете Тестовый доступ к Электронно-библиотечной системе IPRbooksПодробности Опубликовано 11.11.2019Уважаемые читатели! C 08.11.2019 г. по 31.12.2019 г. нашему университету предоставлен бесплатный тестовый доступ к крупнейшей российской полнотекстовой базе данных - Электронно-библиотечной системе IPR BOOKS . ЭБС IPR BOOKS содержит более 130 000 изданий, из которых более 50 000 - уникальные учебные и научные издания. На платформе Вам доступны актуальные книги, которые невозможно найти в открытом доступе в сети Интернет. Доступ возможен со всех компьютеров сети университета. Для получения удаленного доступа необходимо обратиться в отдел электронных ресурсов (ауд. 1247) к администратору ВЧЗ Склеймовой Полине Юрьевне или по электронной почте [email protected] с темой "Регистрация в IPRbooks". |
Популярное:
Как решать уравнения с модулем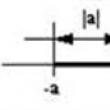
|
Новое
- Иван III – Государь всея Руси
- Первые металлургические мануфактуры тульского края Где появились первые металлургические заводы
- Формирование ууд на уроках в начальной школе презентация к уроку на тему
- Презентация "герой сталинградской битвы василий григорьевич зайцев"
- Маргинал или изгой общества Кто это такой
- Студенческие строительные отряды (ссо - вссо) Движение вссо как называли в ссср
- Целебные свойства марганцовки — полезные советы
- Подготовка к егэ по обществознанию
- Гитлер в «Mein Kampf»: «Русские – великий народ» - aquilaaquilonis
- Бои на Халхин-Голе (1939)